Alguns exemplos cotidianos de reação química
Existem muitos exemplos de reações químicas no cotidiano. Entre eles estão a formação da ferrugem num pedaço de palha de aço, o apodrecimento dos alimentos, a produção de húmus no solo, a queima de gás num fogão e de gasolina, álcool ou óleo diesel no motor de um veículo.
A ocorrência de uma reação química nem sempre é fácil de perceber. Algumas só podem ser percebidas em laboratórios suficientemente equipados para separar componentes das misturas obtidas e determinar as suas propriedades. Há, contudo, algumas evidências que, estão, de modo geral, associadas à ocorrência de reações químicas e que são, portanto, pistas que podem indicar sua ocorrência. Entre essas evidências estão:
- liberação de calor – por exemplo, nas combustões;
- mudança de cor – por exemplo, quando um alvejante é derrubado, por descuido, num roupa colorida;
- mudança de odor – por exemplo, quando frutas, carnes e outros alimentos se estragam;
- liberação de gás – por exemplo, ao jogar um comprimido efervescente em água.
Reagente e produtos
As substâncias inicialmente presentes num sistema e que se transformam em outras devido à ocorrência de uma reação química são denominadas reagentes. E as novas substâncias produzidas são chamadas de produtos.
Assim, por exemplo:
Em equação: ![]()
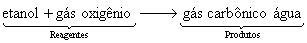
Em palavras: Os reagentes etanol e gás oxigênio reagem para formar os produtos gás carbônico e água.
Em equação: ![]()
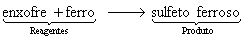
Em palavras: Os reagentes enxofre e ferro reagem para formar o produto sulfeto ferroso.
Lei da conservação da Massa, de Lavoisier
Esta lei foi elaborada, em 1774, pelo químico francês Antoine Laurent Lavoisier. Os estudos experimentais realizados por Lavoisier levaram-no a concluir que numa reação química, que se processa num sistema fechado, a soma das massas dos reagentes é igual à soma das massas dos produtos:
m (reagentes) = m (produtos)
Assim, por exemplo, quando 2 gramas de hidrogênio reagem com 16 gramas de oxigênio verifica-se a formação de 18 gramas de água; quando 12 gramas de carbono reagem com 32 gramas de oxigênio ocorre a formação de 44 gramas de gás carbônico.
Essa lei, inclusive, incorporou-se aos "saberes populares", sendo frequentemente enunciada como:
"Na natureza nada se cria, nada se perde, tudo se transforma."
Lei das proporções constantes (lei de Proust)
Esta lei foi elaborada, em 1797, pelo químico Joseph Louis Proust. Ele verificou que as massas dos reagentes e as massas dos produtos que participam de uma reação química obedecem sempre a uma proporção constante. Esta proporção é característica de cada reação e independente da quantidade das substâncias que são colocadas para reagir. Assim, para a reação entre hidrogênio e oxigênio formando água, os seguintes valores experimentais podem ser obtidos:
Experimento | hidrogênio (g) | oxigênio (g) | água (g) |
I | 10 | 80 | 90 |
II | 2 | 16 | 18 |
III | 1 | 8 | 9 |
IV | 0,4 | 3,2 | 3,6 |
Observe que:
- para cada reação, a massa do produto é igual à massa dos reagentes, o que concorda com a lei de Lavoisier;
- as massas dos reagentes e do produto que participam das reações são diferentes, mas as relações massa de oxigênio/massa de hidrogênio, massa de água/massa de hidrogênio e massa de água/massa de oxigênio são sempre constantes.
Experimento | m oxigênio/m hidrogênio | m água/m hidrogênio | m água/oxigênio |
I | 8/10 = 8 | 90/10 = 9 | 90/80 = 1,125 |
II | 16/2 = 8 | 18/2 = 8 | 18/16 = 1,125 |
III | 8/1 = 8 | 9/1 = 9 | 9/8 = 1,125 |
IV | 3,2/0,4 = 8 | 3,6/0,4 = 9 | 3,6/3,2 = 1,125 |
No caso das reações de síntese, isto é, aquelas que originam uma substância, a partir de seus elementos constituintes, o enunciado da lei de Proust pode ser o seguinte:
Resumindo:
A proporção, em massa, dos elementos que participam da composição de uma substância é sempre constante e independe do processo químico pelo qual a substância é obtida.
Comentários
Postar um comentário