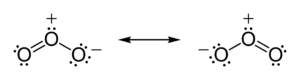
Fonte: https://www.coladaweb.com/quimica/fisico-quimica/tipos-de-radiacao-alfa-beta-e-gama
Tipos de Radiação: Alfa, Beta e Gama
Existem três tipos de radiação: alfa, beta e gama. Becquerel, Ernest Rutherford, da Nova Zelândia, e Marie e Pierre Curie, da França, foram os responsáveis pela sua identificação.
Quando submetemos as emissões radioativas naturais, por exemplo do polônio ou do rádio, um campo elétrico ou magnético, notamos a sua subdivisão em três tipos bem distintos.
⋅ A emissão que sofre pequeno desvio para o lado da placa negativa foi denominada emissão alfa.
⋅ A que sofre desvio maior para o lado da placa positiva foi denominada emissão beta
⋅ A que não sofre desvio foi chamada de emissão gama
Tipos de Radiação
Radiação Alfa
Os raios Alfa tem uma carga elétrica positiva. Consistem em dois prótons e dois nêutrons, e são idênticos aos núcleos dos átomos de hélio. Os raios alfa são emitidos com alta energia, mas perdem rapidamente essa energia quando passam através da matéria. Uma ou duas folhas de papel podem deter os raios alfa.
Quando um núcleo emite uma partícula alfa, perde dois prótons e dois nêutrons. Por exemplo, a radiação alfa ocorre no U238um isótopo do urânio que tem 92 prótons e 146 nêutrons. Após a perda de uma partícula alfa, o núcleo tem 90 prótons e 144 nêutrons. O átomo com número atômico 90 não é mais o urânio, mas o tório. o isótopo formado é o 12Th234
Radiação Alfa
As partículas alfa são núcleos de hélio. Consistem em dois prótons e dois nêutrons que se comportam como uma partícula única.
O núcleo do rádio, no qual prótons e nêutrons se unem para formar uma partícula alfa.
A partícula alfa é emitida pelo núcleo.
Radiação Beta
Alguns núcleos radioativos emitem elétrons comuns, que tem a carga elétrica negativa. Há os que emitem pósitrons, que são elétrons positivamente carregados. As partículas beta se propagam com velocidade quase igual à da luz. Alguns podem penetrar mais de 1 cm de madeira.
Quando um núcleo emite uma partícula beta, também emite um neutrino. Um neutrino não tem carga elétrica e quase não tem massa. Na radiação de partículas beta negativas, um nêutron no núcleo transforma-se em um próton, um elétron negativo e um neutrino.
O elétron e o neutrino são emitidos no instante em que se formam, e o próton permanece no núcleo. Isto significa que o núcleo passa a conter mais um próton e menos um nêutron. Por exemplo, um isótopo de carbono, o 6C14, emite elétrons negativos. O C14, tem oito nêutrons e seis prótons. Quando se desintegra, um nêutron se transforma em um próton, um elétron e um neutrino. Após a emissão do elétron e do neutrino, o núcleo contém sete prótons e sete nêutrons. Seu número de massa permanece o mesmo, mas seu número atômico aumenta de um. O elemento com número atômico sete é o nitrogênio. Assim, o 6C14 transforma-se no 7N14 após a emissão de uma partícula beta negativa.
Quando o núcleo emite um pósitron, um próton do núcleo transforma-se em um nêutron, um pósitron e um neutrino. O pósitron e o neutrino são emitidos no mesmo instante da sua formação, e o nêutron permanece no núcleo. Um isótopo de carbono, o 6C11, emite pósitrons. O C11 tem seis prótons e cinco nêutrons.
Após a emissão do pósitron e do neutrino, o núcleo contém cinco prótons e seis nêutrons. O número de massa permanece o mesmo, mas o número atômico cai de um. O elemento de número atômico cinco é o boro. Assim, o 6C11 transforma-se no 5B11 após a emissão de um pósitron e de um neutrino.
Radiação Beta
As partículas beta são elétrons em alta velocidade emitidos por certos átomos radioativos.
Os elétrons negativos formam-se pela desintegração de um nêutron. Os elétrons positivos formam-se pela desintegração de um próton.
A partícula beta é arremessada no instante em que se forma. Um neutrino, uma partícula quase sem peso, também é emitido.
Radiação Gama
Os raios gama não tem carga elétrica. São semelhantes ao raio x, mas normalmente tem um comprimento de onda mais curto. Esses raios são fótons (partículas de radiação eletromagnética) e se propagam com a velocidade da luz. São muito mais penetrantes do que as partículas alfa e beta.
A radiação gama pode ocorrer de diversas maneiras. Em um processo, a partícula alfa ou beta emitida por um núcleo não transporta toda a energia disponível. Depois da emissão, o núcleo tem mais energia do que em seu estado mais estável. Ele se livra do excesso emitindo raios gama. Nenhuma transmutação se verifica pelos raios gama.
Radiação Gama
Os raios gama são partículas, ou fótons, de energia eletromagnética.
Núcleo do radio.
Os raios gama são liberados quando um núcleo, após uma desintegração radioativa, fica num estado de alta energia.
Por: Renan Bardine