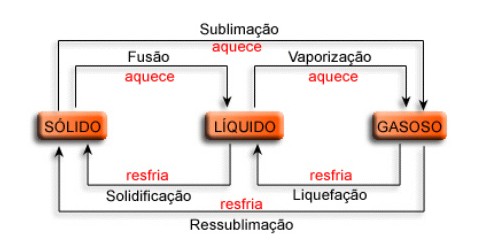
Fonte: https://www.infoescola.com/fisico-quimica/mudancas-de-estado-fisico/
Mudanças de Estado Físico
O que caracteriza e define um estado físico da matéria são as forças atuantes em seu interior; coesão, a qual tende a aproximar as partículas, e repulsão, a qual tende a afastá-las. Quando a força de coesão supera a de repulsão, a substância se apresentará na fase de agregação chamada de sólido, quando as forças apresentarem a mesma intensidade, teremos um líquido, quando a de repulsão superar a de coesão, teremos então um gás. Cada um desses estados físicos distingue-se dos outros, entre outros fatores, por sua forma e volume. O estado sólido apresenta forma e volume constante, o líquido forma variável e volume constante, e o gasoso, forma e volume variáveis.
Na fase de agregação sólida, as partículas não apresentam liberdade de movimento, cabendo-lhes apenas movimentos de ordem vibracional, e a matéria terá maior densidade molecular. No estado líquido, as partículas podem literalmente “rolar” umas sobre as outras. Já na fase gasosa, as partículas terão ampla liberdade de movimento, e a matéria estará em sua fase de menor densidade molecular possível.
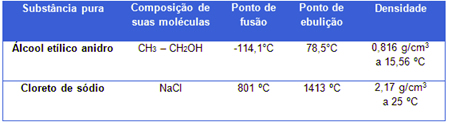
A matéria pode apresentar-se em qualquer estado físico, dependendo dos fatores pressão e temperatura. Assim, de modo geral, o aumento de temperatura e a redução de pressão favorecem o estado gasoso, e pode-se dizer que o inverso favorece ao estado sólido. As transformações de estado físico da matéria apresentam denominações características, como se pode ver abaixo:
a) FUSÃO: representa a passagem do estado sólido para o estado líquido. A temperatura na qual ocorre recebe o nome de Ponto de Fusão. Por exemplo, o derretimento de um cubo de gelo.
b) VAPORIZAÇÃO: representa a passagem do estado líquido para o estado gasoso. A temperatura na qual ocorre recebe o nome de Ponto de Ebulição. Uma vaporização pode ocorrer de três modos distintos:
CALEFAÇÃO: passagem do estado líquido para o gasoso de modo muito rápido, quase instantâneo. Por exemplo, gotas de água sendo derramadas em uma chapa metálica aquecida.
EBULIÇÃO: passagem do estado líquido para o estado gasoso por meio de aquecimento direto, envolvendo todo o líquido. Por exemplo, o aquecimento da água em uma panela ao fogão.
EVAPORAÇÃO: passagem do estado líquido para o estado gasoso que envolve apenas a superfície do líquido. Por exemplo, a secagem de roupas em um varal.
c) LIQUEFAÇÃO ou CONDENSAÇÃO: representa a passagem do estado gasoso para o estado líquido. Por exemplo, a umidade externa de um frasco metálico ao ser exposto a uma temperatura relativamente elevada.
d) SOLIDIFICAÇÃO: representa a passagem do estado líquido para o estado sólido. Por exemplo, o congelamento da água em uma forma de gelo levada ao refrigerador.
e) SUBLIMAÇÃO: representa a passagem do estado sólido para o estado gasoso ou o processo inverso, sem passagem pelo estado líquido. Por exemplo, a sublimação do gás carbônico sólido, conhecido por gelo seco, em exposição à temperatura ambiente.
Referências:
FELTRE, Ricardo, Química Geral, Vol. I, Ed. Moderna, 6° Ed., São Paulo/SP, 2004.
Ilustração: http://www.profjoaoneto.com/quimicag/estadex.htm
Fonte: https://querobolsa.com.br/enem/quimica/misturas-homogenea-e-heterogenea
Misturas
Misturas são formadas por duas ou mais substâncias
puras e apresentam propriedades diferentes daquelas apresentadas pelas substâncias
puras.Um exemplo de mistura é o ar atmosférico, que é composto pelo gás nitrogênio (N2),
gás oxigênio (O2), gás carbônico (CO2) e diversas outras substâncias puras.
A água do mar também é considerada uma mistura composta de água pura (H2O) e sais,
como o cloreto de sódio (NaCl).
Observe a Figura 3:
Figura 3: Misturas entre água e óleo e água e sal.
Perceba na figura acima que quando misturamos água com óleo,
o aspecto visual da mistura não é uniforme, apresentando duas fases bem distintas.
Cada uma das fases vai possuir características diferentes. Já a mistura entre a água
e o sal apresenta um aspecto uniforme, com uma única fase, que vai possui
características iguais em toda a sua extensão.
Fase é, portanto, cada uma das porções que possui aspecto visual uniforme,
que pode ser contínuo ou não, até mesmo quando é observado em um microscópio comum.
As misturas podem ser classificadas em função do número de fases em homogêneas
ou heterogêneas.
- Misturas Homogêneas
Misturas homogêneas, também chamadas de solução, ocorrem toda vez que uma
mistura apresenta uma única fase e são classificadas como monofásicas, como mostra a
Figura 4.
Figura 4: Mistura homogênea.
Exemplos de misturas homogêneas: água e sal, água e açúcar, água e álcool, ar
(sem partículas sólidas em suspensão), bronze, gasolina, vinagre.
- Misturas Heterogêneas
Misturas heterogêneas ocorrem toda vez que uma mistura apresenta
duas ou mais fases e são classificadas como polifásicas, como mostra a Figura 5.
Figura 5: Misturas heterogêneas.
Exemplos de misturas heterogêneas: água e gelo, água e óleo, areia, sangue, leite.
Algumas vezes não é possível detectar se uma mistura é homogênea ou
heterogênea a olho nu. Existem misturas que só revelam seu caráter heterogêneo
quando são observadas ao microscópio, como ocorre no caso do leite, do sangue, da
maionese, das tintas, da neblina, da fumaça, da geleia, dentre outras.
Essas misturas nas quais existem pequenas partículas suspensas são denominadas
coloides.
Os principais tipos de coloides são:
- Aerossóis: tratam-se de partículas líquidas ou sólidas suspensas em um meio gasoso.
Exemplos: fumaça e vapor.
- Espuma: trata-se de partículas gasosas suspensas em um líquido ou sólido.
Exemplos: cremes de barbear e marshmallows.
- Emulsões: trata-se de partículas líquidas suspensas em outro líquido ou sólido.
Exemplos: maionese e manteiga.
- Acrossóis: trata-se de partículas sólidas suspensas em um líquido.
Exemplos: tintas, gelatina e sangue.