Fonte: https://www.todamateria.com.br/elementos-quimicos/
Elementos Químicos
Os elementos químicos correspondem ao agrupamento de átomos que apresentam a mesma quantidade de prótons, ou seja, mesmo número atômico.
Atualmente, existem 118 elementos químicos, sendo que 92 são naturais (encontrados na natureza) e 26 são artificiais e produzidos de maneira artificial.
Representação
Todos os elementos químicos conhecidos estão presentes na tabela periódica. Eles são representados por uma sigla, onde a primeira letra é maiúscula. Se essa sigla tiver duas letras, a segunda será minúscula, por exemplo:
Elemento Ferro – sigla Fe
Além disso, na tabela periódica são indicadas algumas informações importantes sobre o elemento. As principais são: nome, símbolo, número atômico, massa atômica e distribuição eletrônica.

Fonte: https://mundoeducacao.uol.com.br/quimica/ions.htm
Os íons são átomos que ganham ou perdem elétrons durante uma reação, podendo ser classificado em: ânions ou cátions.
Você sabe o que significa os sinais positivo e negativo destes elementos? Eles aparecem para indicar a presença de íons, neste caso se trata dos íons participantes da reação de formação do Cloreto de Sódio:
Na+ + Cl- ↔ NaCl
A seta indica que a reação é reversível.
Os íons explicam porque o composto é formado: o átomo de sódio (Na) não é estável, pois apresenta 1 elétron livre na camada de valência, a estabilidade só será atingida se ele perder um elétron, o que dará origem ao cátion Na+. O átomo de cloro (Cl-) por sua vez também não é estável, pelos mesmos motivos que o Na, e atingirá a estabilidade somente se ganhar um elétron, esse átomo dá origem ao íon Cl-. Sendo assim, a ligação iônica surge através da interação eletrostática e obedece a regra: cargas com sinais opostos se atraem.
Os compostos iônicos adquirem estrutura eletronicamente neutra por possuírem a mesma quantidade de prótons e elétrons, mas os íons formadores, pelo contrário: são reativos e instáveis.
Resumindo: Íons são átomos que perdem ou ganham elétrons durante reações, eles se classificam em ânions e cátions:
Ânion (íon negativo): átomo que recebe elétrons e fica carregado negativamente. Exemplos: F-1, O-2.
Cátion (íon positivo): átomo que perde elétrons e adquire carga positiva. Exemplos: Mg+2, Pb+4.
Exemplos de ionização de elementos químicos:
9F → 9F-
Átomo neutro recebe 1 elétron
O átomo de Flúor (F) se encontrava eletricamente neutro, mas como ganhou 1 elétron passou a se apresentar como um Ânion.
40Ca → 40Ca2+
Átomo neutro perde 2 elétrons
O átomo de Cálcio (Ca) perdeu 2 elétrons e passou a ser um cátion.
Publicado por: Líria Alves de Souza
REGRA DO OCTETO
A regra do octeto, também definida como teoria do octeto, abrange a necessidade de átomos possuírem oito elétrons em sua camada de valência. O número em questão geraria a estabilidade química do elemento em questão.
Assim, o que diz a Regra do Octeto:
“[…] estabelece-se que, em uma ligação química, um átomo tende a ficar com oito elétrons em sua camada de valência no estado fundamental, semelhante a um gás nobre.”Para atingir a estabilidade química, e, consequentemente, apresentar os oito elétrons na camada de valência, ligações químicas são necessárias. Elas serão as responsáveis por receber, ceder ou compartilhar elétron.
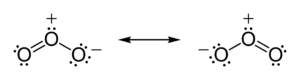
A tendência dos átomos é compartilhamento de elétrons até que adquiram a estabilidade. Sendo assim, até que a camada de valência atinja a completude química.
Por meio disso, o átomo apresentará distribuição de elétrons similar a um gás nobre (que conta com estabilidade natural) mais próximo ao seu número atômico.
Oriundos da Família 8A, os gases nobres são os elementos oriundos da tabela periódica que apresentam oito elétrons na camada de valência. A este caso, a única exceção é o Hélio, um gás que apresenta apenas dois elétrons na camada de valência.
Entretanto, é importante ressaltar que o Hélio alcança sua estabilidade química com estes dois elétrons. O Hélio e os demais gases, assim, já são naturalmente adequados à regra do octeto.
Quando um elemento apresenta oito elétrons na camada de valência, ele está estável quimicamente. Ou seja, ele não se ligará com os demais átomos, por não perde ou ganhar elétrons.
É por esse motivo que não existem ligações químicas envolvendo gases nobres.
Exemplos de Regra do Octeto
Dois exemplos para exemplificar a regra do octeto são o Cloro e o Oxigênio. Sendo assim, temos:
- Cloro: com número atômico 17 e sete elétrons na camada de valência. Para formar a molécula Cl2, há um compartilhamento de elétrons para alcançar a estabilidade.
- Oxigênio: conta com seis elétrons na camada de valência. A fim e alcançar a estabilidade, ele precisará receber dois elétrons a fim de atingir a estabilidade. Exemplo disso é a ligação com hidrogênio, formando a água.
Exceções da regra do octeto
Em toda a regra, a exceção existe. Na Teoria do Octeto não é diferente. Assim, teremos duas pontuais exceções à regra.
Elementos estáveis com menos de oito elétrons: trata-se da chamada contração do octeto. Neste, elementos atingiriam a estabilidade com menor número de elétrons do que oito. O Boro (B) e o Alumínio (Al), por exemplo, tornam-se estáveis com apenas seis elétrons na camada de valência.
Estáveis com mais de oito elétrons: trata-se da chamada expansão do octeto. Nele, elementos alcançarão a estabilidade sobrepondo os oito elétrons da camada de valência. São exemplos o Fósforo (P) e o Enxofre (S), que podem receber até 10 e 12 elétrons, respectivamente.
Referências
SALVADOR, Edgard e USBERCO, João. Química, volume único. 1ª edição, Editora Saraiva, São Paulo-SP, 2006. 672 p.
Ao nosso redor vemos uma grande diversidade de substâncias. Elas se diferenciam por muitos aspectos, como cor, estado físico (sólido, líquido e gasoso), cheiro, sabor, capacidade de entrar em combustão, pontos de fusão e ebulição, densidade etc.
Isso se deve à capacidade que o átomo tem de combinar com outros átomos, seja de um mesmo elemento, seja de um elemento diferente, com a finalidade de realizar ligações químicas.
Em 1920, Gilbert Newton Lewis chamou essa propriedade de chemical bond, que em português significa ligação química. Assim, a ligação química se estabelece quando átomos combinam (reagem) entre si.
No entanto, surgem algumas questões:
Por que o átomo possui essa tendência de realizar ligações químicas?
E por que determinados átomos se sentem mais atraídos em realizar ligações com átomos de certos elementos do que com outros?
Bom, a ligação química se estabelece entre os elétrons da camada mais externa da eletrosfera (camada de valência). Para tanto, duas características são essenciais:
- A força de atração eletrostática que existe entre as cargas elétricas de sinais opostos;
- A tendência que os elétrons têm de formar pares.
Em 1916, Gilbert N. Lewis e Walter Kossel observaram que, na natureza, apenas os gases nobres (elementos da família 18, VIIIA ou 0 da tabela periódica) eram encontrados isolados na natureza. Isso acontecia porque eles tinham uma característica que os outros átomos não tinham: todos os elementos dessa família (com exceção do hélio, que tem apenas uma camada eletrônica) possuem a camada de valência de seus átomos preenchida com oito elétrons.
Associando essa observação com as ligações realizadas pelos átomos dos elementos das outras famílias da Tabela Periódica, eles criaram uma hipótese chamada de regra ou teoria do octeto, que está enunciada a seguir:

Assim, para ficar estável, o átomo troca elétrons (compartilhando ou recebendo e doando), com a finalidade de possuir oito elétrons na camada de valência. As principais ligações químicas são três:

Para entender melhor cada uma dessas ligações e ver como elas resultam nas propriedades dos compostos, leia outros textos de Química em nosso site. Alguns estão listados abaixo:
Video poker videos (for free). youtube
ResponderExcluirVideo poker mp3 juice videos for free. Watch for free on video-poker.com. No signup or registration required. Try the free online poker game now.